Asam Kuat
Asam kuat adalah asam yang terionisasi hampir sempurna (α = 1) dalam larutan. Artinya, hampir semua molekul asam melepaskan ion H+ ketika dilarutkan dalam air. Apabila suatu asam dilarutkan dalam air akan mengubah konsentrasi H+ dan OH– dari air. Jika konsentrasi H+ semakin besar dan konsentrasi OH– semakin kecil, maka larutannya akan semakin asam. Secara umum persamaan reaksi asam kuat sebagai berikut: HA(aq) → H+(aq) + A–(aq)
Untuk menghitung konsentrasi ion H+dalam larutan asam dapat menggunakan rumus sebagai berikut:
[H+] = Mα x α
Keterangan :
[H+] = konsentrasi ion H+ (mol/L atau Molar)
Ma = Molaritas asam kuat (mol/L atau Molar)
α = valensi asam kuat.
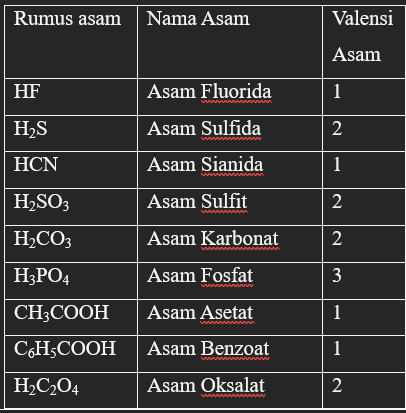
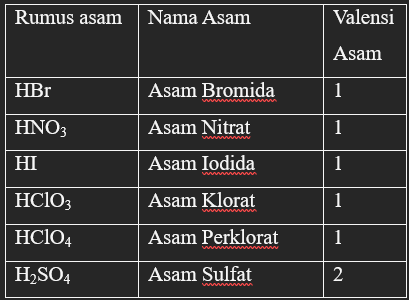
Contoh senyawa asam kuat
Asam Lemah
Asam lemah adalah asam yang hanya terionisasi sebagian (α < 1) dalam larutan. Artinya, hanya sebagian kecil molekul yang melepaskan ion H⁺, sisanya tetap dalam bentuk molekul. Jika asam lemah HA dilarutkan di dalam air, maka akan mengalami reaksi penguraian menjadi ion H+ dan ion A– .
HA(aq) ⇋ H+(aq) + A–(aq)
HA membentuk keadaan setimbang, Tetapan kesetimbangan untuk asam lemah disebut tetapan ionisasi asam lemah yang dilambangkan dengan Ka . Rumusnya adalah :
Ka = [H+].[A–] / [Ha]
semakin besar Ka, semakin kuat asamnya
nilai [H+] = [A–], maka persamaan di atas diubah menjadi:
[H+] = √( Ka[HA] )
atau
[H+] = √Ka x M
Contoh senyawa asam lemah