Basa Kuat
Basa kuat adalah basa yang terionisasi hampir sempurna dalam air hampir semua molekulnya melepaskan ion OH–. Memiliki derajat ionisasi (α) = 1.
Secara umum, persamaan reaksi ionisasi basa kuat sebagai berikut.
BOH(aq) à B+(aq) + OH–(aq)
Senyawa basa yang dilarutkan dalam air mengubah konsentrasi H+ dan OH– dalam air, yang mana jika konsentrasi H+ semakin kecil dan konsentrasi OH– semakin besar, maka larutan tersebut akan semakin basah.
Untuk menghitung konsentrasi ion OH– dalam larutan asam dapat menggunakan rumus sebagai berikut:
[OH–] = Mb x b
Keterangan:
[OH–] = konsentrasi ion OH– (mol/L atau Molar)
Mb = Molaritas basa kuat (mol/L)
b = valensi basa kuat
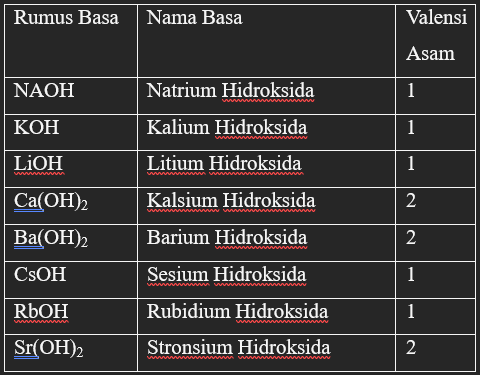
Contoh senyawa basa kuat
Basa Lemah
Basa lemah adalah basa yang hanya terionisasi sebagian dalam air, hanya sebagian molekul yang menghasilkan ion OH–. Memiliki derajat ionisasi (α) lebih dari 0 dan kurang dari 1. Jika basa lemah BOH dilarutkan di dalam air, maka akan terurai menjadi ion B+ dan ion OH– . Persamaan reaksi ionisasi basa lemah secara umum sebagai berikut.
B(OH)(aq) ⇋ B+(aq) + OH–(aq)
Memiliki nilai tetapan Ionisasi (Kb).
Kb = [B+].[OH–] / [ M(OH) ]
Hubungan Kb dan Ka
yang mana kekuatan basa berbanding terbalik dengan asam konjugatnya, jika asam makin lemah maka basa konjugatnya semakin kuat dan sebaliknya
persamaan menunjukkan ionisasi basa, menggunakan amonia sebagai contoh
[NH4+].[OH–]/[NH3] = Kb
dimana b pada “Kb” berarti “basa”. karena [OH–] dan [H3O+] dihubungkan melalui persamaan kesetimbangan autoionisasi air
[OH–][H3O+] = Kw
persamaan Kb dapat ditulis sebagai
Kb = [NH4+]Kw / [NH3][H3O+] = Kw/Ka
dimana Ka adalah tetapan ionisasi asam, hubugan umum antara Kb dari suatu basa dengan Ka dari asam konjugatnya ini menunjukkan bahwa Kb tidak perlu ditabelkan secara terpisah dari Ka, karena keduanya terhubung
Sehingga menjadi :
Kw = Ka x Kb
Semakin kuat basa, maka reaksi kesetimbangan semakin bergeser ke kanan ke arah produk, sehingga harga Kb semakin besar. Berdasarkan persamaan tersebut, pada basa lemah nilai [B+] = [OH–] maka persamaan di atas dapat diubah menjadi :
[OH–] = √(Kb [ B(OH) ] )
atau
[OH–] = √Kb x M
Contoh senyawa basa Lemah
